Sažetak
UVOD: Klinički značaj enzima karbapenemaza ogleda se u njihovoj sposobnosti hidrolize karbapenema, zbog čega bakterije koje ih proizvode razvijaju otpornost na ovu podskupinu β – laktamskih antibiotika širokog spektra, kao i na većinu ostalih pripadnika iste skupine (penicilini, cefalosporini). Za dokazivanje karbapenemaza producirajućih sojeva u mikrobiološkom laboratoriju koriste se klasične fenotipske metode zasnovane na kultivaciji, nakon čega je neophodno potvrditi produkciju enzima primjenom potvrdnih (fenotipskih i/ili molekularnih) metoda.
CILJEVI ISTRAŽIVANJA: Ispitati fenotipske osobine bolničkih izolata Acinetobacter baumannii: odrediti rezistotip ispitivanih sojeva; ispitati prisustvo karbapenemaza kod ispitivanih sojeva; utvrditi distribuciju izolata po uzorcima i klinikama; ispitati postojanje korezistencije bolničkih sojeva Acinetobacter baumannii na ostala antimikrobna sredstva; izgraditi algoritam detekcije karbapenemaza kod bolničkih sojeva Acinetobacter baumannii u laboratorijskoj praksi.
MATERIJAL I METODE RADA: Istraživanje je obavljeno retrospektivno – prospektivno. Studija je obuhvatila period od 01.01.2014 – 31.05.2015. godine. Istraživanjem su obuhvaćena 53 izolata Acinetobacter baumannii koji su pokazali rezistenciju na karbapeneme. Izolacija i identifikacija Acinetobacter baumannii izvršena standardnim laboratorijskim metodama i VITEK 2 Compact sistemom firme BioMerieux. Ispitivanje osjetljivosti na antibiotike vršilo se disk-difuzionom metodom, automatiziranom metodom (VITEK 2), E – testom. Detekcija mehanizama rezistencije je rađena sljedećim fenotipskim testovima: modificiranim Hodge testom, E – testom MBL-a, upotrebom kombiniranih diskova.
Summary
INTRODUCTION:Carbapenemases are clinically important enzymes because they hydrolyse and inact vate the broad-spectrum β-lactam antibiotics carbapenems. Carbapenemase-producing strains are resistant to carbapenems and to most of the other classes of β-lactams (penicillins, cepha- losporins). The growing trend of the carbapenemase-producing strains between inpatient and outpatient isolates of gram-negative bacteria is becoming a global health threat. Infections caused by carbapenemase-producing strains often occur as outbreaks. In addition, carbapene- mase-encoding genes are frequently transferred to other bacteria along with the genes respon sible for resistance to other classes of antibiotics, such as quinolones and aminoglycosides. . Phenotypic methods based on cultivation are used for screening of carbapene- mase-producing strains, however, enzyme production must be confirmed by phenotypic or molecular method
REASERCH OBJECTIVES:To examine the phenotypic characteristics of Acinetobacter baumannii hospital izolaza: determine resistotypes tested strains; Check the presence of carbapenemases in these strains;
Identify the distribution of isolates per sample and clinics; To examine drug resistance of Acinetobacter baumannii from hospitals to other antimicrobials; To develop the algorithm detection carbapenemases in hospital strains of Acinetobacter
MATERIALS AND METHODS:This study was conducted retrospectively – prospectively. The study included the period from 01.01.2014 to 31.05.2015. year. The research included 53 isolates of Acinetobacter baumannii that showed resistance to carbapenems. Isolation and identification of Acinetobacter baumannii was performed by standard laboratory methods and VITEK 2 Compact system made by BioMerieux. Examinatio of the susceptibility to antibiotics was conducted by methods: disc-diffusion,automated method(VITEK 2) and E-test. The detection mechanisms of resistance was made by the following phenotypic tests: the modified Hodge test, E – test MBL, use of combined disks.
DISCUSSION: The tested strains of Acinetobacter baumannii showed resistance to β – lactam antibiotics, as well as most of the other members of the same groups (penicillins, cephalosporins). With the help of confirmatory testing for production of carbapenemases we proved that the resistance of Acinetobacter baumannii isolates from hospitals to carbapenem usually mediated carbapenemases. Acinetobacter baumannii is usually isolated in samples from the respiratory tract and intensive care unit(ICU). Of the total number of tested strains of Acinetobacter baumannii 41/53 (77.4%) produced metalo- β-laktamase,however in 12/53(22,6%) of the tested strains we found different types of resistances.E test MBL was positive in 41/53(77,36%),MHT in 39/53(73,6%) and ROSCO CDT in 33/53(62,36) samples
CONSLUSION:Resistance of Acinetobacter baumannii isolates from hospitasl to carbapenems is usually mediated by carbapenemases .Of the total number of tested strains of Acinetobacter baumannii in 41/53 (77.4%) cases, we demonstrated the production of metallo-β-lactamase.
Our research has shown that the E-test MBL is a reliable phenotypic test for the detection of MBL production, followed by MHT and CDT Rosco.
In the implementation of infection control measures and continuous monitoring of the appearance of A. baumannii in a hospital setting, the most important role of the microbiological laboratory is the introduction of fast and reliable method of detection of pathogens.
Uvod
Acinetobacter baumannii je široko rasprostranjena, multiplo rezistentna bakterija, sa specifičnim genotipskim i fenotipskim (morfološkim, kulturelnim i biohemijskim) osobinama. Ova bakterija je posebno interesantna zbog njene patogenosti, ali i mehanizama i stepena rezistencije, kako na konvecionalne, tako i na nekonvencionalne antimikrobne agense.
Do danas su poznati i opisani brojni mehanizmi rezistencije prisutni kod ovog mikroorganizama, pa ipak njegovo širenje unutar bolničkih sredina vrlo je teško kontrolisati.
Rizični faktori povezani s Acinetobakter infekcijom uključuju hospitalizaciju, intravenske ili urinarne katetere, antibiotsku terapiju, hroničnu bolest pluća, boravak u jedinicama intenzivne njege i sl. Najčešće se nađu u uzorcima iz disajnih puteva u bolesnika na vještačkoj ventilaciji, iz urina u bolesnika s urinarnim kateterom, kao i iz hemokulture a povezani su s intravenskim kateterima, infekcijama rana kod hirurških bolesnika, bolesnika s opekotinama. To je druga najčešće izolovana nefermentativna bakterija, nakon pseudomonasa.
Zbog raznovrsnosti karbapenemaza i velikog potencijala širenja sojeva koji ih produciraju postoji potreba za brzom i tačnom dijagnostikom koja će omogućiti pravovremeni izbor i primjenu odgovarajuće antimikrobne terapije te epidemiološki nadzor nad širenjem sojeva. Odgođeno prepoznavanje i neprimjereno liječenje teških infekcija uzrokovanih rezistentnim sojevima povećava stopu mortaliteta oboljelih. Rano otkrivanje rezistentnih sojeva u kliničkom laboratoriju ključno je u prevenciji bolničkih infekcija. Nažalost, klasične metode dijagnostike zasnovane na kultivaciji traju nekoliko dana, što odgađa primjenu pravovremene terapije i omogućava nekontrolisano širenje bakterije.
Detekcija karbapenemaza u laboratoriju započinje nekom od metoda ispitivanja osjetljivosti izolovanih sojeva na karbapeneme temeljenim na kultivaciji (disk-difuzijska metoda, E-test, dilucijske metode, automatizirane metode).
Nakon uočene smanjene osjetljivosti enterobakterija na karbapeneme potrebno je provesti potvrdna testiranja za produkciju karbapenemaza.
Postoji nekoliko mogućih metoda od kojih je novim EUCAST-ovim smjernicama preporučena fenotipska metoda upotrebom kombinovanih diskova (engl. combination disk test; CDT), a koriste se i: E-test za detekciju MBL, Modificirani Hodge test, molekularne metode (PCR, DNK čipovi) i dr.
Ciljevi istraživanja
- Ispitati fenotipske osobine bolničkih izolata Acinetobacter baumannii: odrediti rezistotip ispitivanih sojeva
- Ispitati prisustvo karbapenemaza kod ispitivanih sojeva
- Utvrditi distribuciju izolata po uzorcima i klinikama
- Ispitati postojanje korezistencije bolničkih sojeva Acinetobacter baumannii na ostala antimikrobna sredstva
- Izgraditi algoritam detekcije karbapenemaza kod bolničkih sojeva Acinetobacter baumannii u laboratorijskoj praksi
Metode istraživanja
Istraživanje je vršeno u Odjeljenju za kontrolu bolničkih infekcija O.J. Klinička mikrobiologija UKCS.
Klinički materijal je inokuliran na krvni (5%) Columbia agar base (BioMérieux, Francuska) i chromID CPS Media (BioMerieux, Francuska), koji je inkubiran u termostatu na 37 °C/18-24h .
Nakon evidentiranja bakterijskog porasta, identifikacija do nivoa vrste je vršena klasičnim bakteriološkim metodama (morfološkim, kulturelnim i fiziološko-biohemijskim) i automatizovanim Vitek 2 Compact sistemom (BioMérieux, Francuska). Ispitivanje osjetljivosti na antibiotike izvršeno je disk – difuzionom metodom, automatiziranom metodom (VITEK 2) i E – testom. Detekcija mehanizama rezistencije na sojevima koji su pokazali rezistenciju na karbapeneme je izvršena pomoću slijedećih testova: Modificirani Hodge test (engl. Modified Hodge Test; MHT), E – test MBL, Test kombinacije diskova (CDT CARBA) za detekciju karbapenemaza.
Rezultati istraživanja
Ukupno smo testirali 53 soja Acinetobacter baumanni kojim je prethodno dokazana rezistencija na karbapeneme. Ispitivanje osjetljivosti na antibiotike izvršeno je disk – difuzionom metodom, automatiziranom metodom (VITEK 2) i E – testom.
Svim pacijentima kod kojih je izolovan Acinetobacter baumannii su iz prijave bolničke infekcije/kolonizacije uzeti sljedeći podatci: spol, dob, klinika na kojoj je hospitaliziran, uzorak iz kojeg je izolovan Acinetobacter baumannii, prethodni operacijski (invazivni) zahvati, prisustvo CVK, mehanička ventilacija, urinski kateter ili prisustvo drugog biomaterijala.
Tabela 1. Prikaz spolne zastupljenosti ispitanika
| SPOL | N | % |
| Muški | 32 | 60,4 |
| Ženski | 21 | 39,6 |
| Ukupno | 53 | 100,0 |
χ2=2,283; p=0,131
Nije bilo statistički signifikantne razlike u zastupljenosti spolova (χ2=2,283; p=0,131).
U tabeli 2. je prikazana starosna struktura ispitanika koji su obuhvaćeni ovim istraživanjem. Prosječna starosna dob je iznosila 44±27.9 godina (0-88godina).
Tabela 2. Prosječna starost ispitanika
| STAROSNA SKUPINA | N | % |
| 0-10 | 14 | 26,4 |
| 11-20 | 5 | 9,4 |
| 21-30 | 3 | 5,7 |
| 31-40 | 5 | 9,4 |
| 41-50 | 6 | 11,3 |
| 61-60 | 5 | 9,4 |
| 61-70 | 9 | 17 |
| 71-80 | 5 | 9,4 |
| 81-90 | 1 | 2 |
| UKUPNO | 53 | 100 |
p=0,0001
Analiza prosječne dobi prema grupama pacijenata pokazuje da su pacijenti u grupi od 0-10 i od 61-70 godina starosti statistički značajnije zastupljeni u odnosu na druge starosne grupe.
Od ukupno 53 testirana soja na Klinici za pedijatriju dokazano je 14 (26,4%), Jedinici intenzivne internističke terapije 10 (18,9%) i Klinici za anesteziju i reanimaciju 8 (15,1%) izolata. Na navedenim klinikama dokazana je statistički značajna razlika u zastupljenosti A. baumannii u odnosu na ostale klinike.
Tabela 3. Zastupljenost izolata A. baumannii u odnosu na klinike
| KLINIKA | N | % |
| ABDOMINALNA HIRURGIJA | 1 | 1,9 |
| ANGIOLOGIJA | 1 | 1,9 |
| B6 | 1 | 1,9 |
| C3 | 8 | 15,1 |
| INFEKCIJA | 5 | 9,4 |
| JIIT | 10 | 18,9 |
| NH 2 | 3 | 5,7 |
| NH JIM | 4 | 7,5 |
| ORTOPEDIJA | 3 | 5,7 |
| PEDIJATRIJA | 14 | 26,4 |
| PO | 3 | 5,7 |
| Ukupno | 53 | 100,0 |
χ2=16,453; p=0,0001
(B6-Klinika za dječiju hirurgiju, C3-Klinika za anesteziju i reanimaciju, JIIT- Jedinica intenzivne internističke terapije, NH2- Klinika za neurohirurgiju, NH JIM- Klinika za neurohirurgiju, intenzivna njega, PO- Klinika za rekonstruktivnu i plastičnu hirurgiju)
U ukupnom uzorku (N=53) ispitivani soj Acinetobacter baumannii je najviše izolovan iz trahealnog aspirata 21/53 (39,6%) i krvi 16/53 (30,2%). Zastupljenost A baumannii u trahealnom aspiratu i u krvi je statistički značajna u odnosu na druge uzorke.
Tabela 4. Distribucija A baumannii prema uzorcima
| UZORAK | N | % |
| CENTRALNI VENSKI KATETER | 1 | 1,9 |
| DREN | 2 | 3,8 |
| KATETER | 3 | 5,7 |
| KRV | 16 | 30,2 |
| RANA | 8 | 15,1 |
| TRAHEALNI ASPIRAT | 21 | 39,6 |
| TUBUS | 1 | 1,9 |
| URIN | 1 | 1,9 |
| UKUPNO | 53 | 100,0 |
t=7,151; p=0,0001
Nakon analize podataka dobivenih iz formulara za prijavljivanje kolonizacije/infekcije bolničkim sojevima bakterija zaključili smo da je 39/53(73,6%) pacijenata imalo bolničku infekciju, a njih 14/53 (26,4) je bilo kolonizirano sa Acinetobacter baumanniii (tabela 5). Statistički značajnije je zastupljena infekcija u odnosu na kolonizaciju izazvanu ovim sojem.
Tabela 5. Odnos kolonizacije/infekcije sa izolatima A. baumannii
| N | % | |
| INFEKCIJA | 39 | 73,6 |
| KOLONIZACIJA | 14 | 26,4 |
| UKUPNO | 53 | 100,0 |
χ2=6,191; p=0,0128
U tabeli 6. prikazane su bolničke infekcije izazvane s ispitivanim sojem Acinetobacter baumannii. Najčešća je septikemija 18/39 (46,2%), ventilator udružena pneumonia (VAP) 13/39 (33,3%) i infekcija rane 7/39 (17,9%). U zastupljenosti septikemije dokazana je statistički signifikantna razlika odnosu na ostale bolničke infekcije.
Tabela 6. Zastupljenost bolničkih infekcija uzrokovanih sa A. baumannii
| VRSTA INFEKCIJE | N | % |
| INFEKCIJA RANE | 7 | 17,9 |
| SEPTIKEMIJA | 18 | 46,2 |
| URINARNA INFEKCIJA | 1 | 2,6 |
| VAP | 13 | 33,3 |
| UKUPNO | 39 | 100,0 |
χ2=10,559; p=0,0144
Najčešći rizoko faktori za nastanak bolničke infekcije bili su centralni venski kateter 26/53 (29,5%) i mehanička ventilacija 23/53 (26,1%). Zabilježena je statistički signifikantna razlika u odnosu na ostale dokazane riziko faktore.
Tabela 7. Najčešći riziko faktori za nastanak bolničke infekcije sa Acinetobacter baumannii
| RIZIKO FAKTORI | N | % |
| RANA | 3 | 3,4 |
| KANILA | 2 | 2,3 |
| STARIJA ŽIVOTNA DOB | 1 | 1,1 |
| DUŽINA HOSPITALIZACIJE | 6 | 6,8 |
| OP ZAHVAT/ REOPERACIJA | 10 | 11,4 |
| URINARNI KATETER | 6 | 6,8 |
| NEONATUS | 9 | 10,2 |
| MEHANIČKA VENTILACIJA | 23 | 26,1 |
| CVK | 26 | 29,5 |
| INTUBACIJA | 2 | 2,3 |
| UKUPNO | 88 | 100 |
χ2=23,359; p=0,005
U prosjeku kod svakog pacijenta je dokazan 1,868 riziko faktor . Zabilježena je signifikantna razlika u odnosu na očekivanu distribuciju χ2=4,868; p=0,182
Tabela 8. Broj riziko faktora po pacjentu
| RIZOKO FAKTORI | I | II | III | IV |
| N | 9 | 14 | 13 | 3 |
| % | 23,1 | 35,9 | 33,3 | 7,7 |
χ2=4,868; p=0,182
Ispitivani sojevi Acinetobacter baumannii pokazali su visoku rezistenciju i na ostale testirane antibiotike. Potpuna rezistencija je zabilježena na 9/11 (82%) testiranih antibiotika. Rezistencija na Tobramicin iznosila je 30/53 (56,6%), a rezistencija na Colistin nije zabilježena (Grafikon 1.).
Grafikon 1. Grafički prikaz unakrsne rezistencije izolata A. baumannii na ostale testirane antibiotike
Mehanizme rezistencije na našim sojevima dokazivali smo pomoću E-testa MBL, Modificiranog Hodge testa i korištenjem testa kombinacije diskova CDT CARBA.
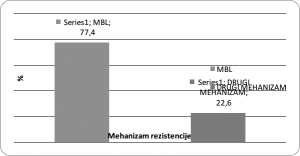
Od ukupnog broja testiranih sojeva Acinetobacter baumannii kod 41/53 (77,4%) smo dokazali produkciju metalo-β-laktamaza (MBL), dok kod 12/53 (22,6%) ispitivanih sojeva se radilo o drugom mehanizmu rezoistencije (Grafikon 2)
Grafikon 2. Distribucija mehanizama rezistencije Acinetobacter baumannii
E test MBL je bio pozitivan u 41/53(77,36%), MHT kod 39/53 (73,6%), a ROSCO CDT kod 33/53 (62,3%) izolata A. baumanni (Tabela 9)
Tabela 9. Rezultati testiranja produkcije karbapenemaza fenotipskim testovima
| TEST | POZITIVAN | NEGATIVAN | UKUPNO | |||
| N | % | N | % | N | % | |
| E TEST MBL | 41 | 77,4 | 12 | 22,6 | 53 | 100 |
| MHT | 39 | 73,6 | 14 | 26,4 | 53 | 100 |
| ROSCO CDT | 33 | 62,3 | 20 | 37,7 | 53 | 100 |
Diskusija
A.baumannii otporna na više antibiotika (MDR AB) je značajan patogen u zdravstvenim ustanovama, gdje uzrokuje mnoštvo infekcija koje uključuju septikemiju, upalu pluća, meningitis, infekcije mokraćnog sistema i infekcije rane. Rjeđe uzrokuje infekciju kože i mekih tkiva, abdomena i infekciju CNS-a.
Infekcije se javljaju kod imunokompromitovanih bolesnika, kod pacijenata s dugom i teškom bolešću , kod pacijenata podvrgnutih invazivnim postupcima i pacijenata koji primaju antibiotike širokog spektra naročito u jedinicama intenzivne njege. Bolnički stečen Acinetobacter baumannii MDR je pravi izazov za kliničare
Laboratorijska detekcija karbapenemaza počinje nakon dokazane smanjene osjetljivosti izolata na karbapeneme u disk-difuzijskom ili dilucijskom testu (MIK za ertapenem ≥ 0,5 μg/ml, MIK za imipenem ili meropenem ≥ 1 μg/ml). Ovo nije pravilo, jer izolati koji luče karbapenemaze ne moraju pokazivati rezistenciju na karbapeneme, što otežava njihovu detekciju i kontrolu širenja. Prema smjernicama EUCAST-a iz 2012. godine meropenem, u smislu osjetljivosti i specifičnosti, može najbolje detektovati proizvodnju karbapenemaza.
Ispitivani sojevi Acinetobacter baumannii pokazali su rezistenciju na β – laktamske antibiotike širokog spektra, kao i na većinu ostalih pripadnika iste skupine (peniciline, cefalosporine).Uz pomoć potvrdnih testiranja za produkciju karbapenemaza dokazali smo da je rezistencija bolničkih izolata Acinetobacter baumannii na karbapeneme najčešće posredovana karbapenemazama. Acinetobacter baumannii najčešće je izolovan u uzorcima respiratornog trakta i na odjelima intenzivne njege. Od ukupnog broja testiranih sojeva Acinetobacter baumannii kod 41/53 (77,4%) smo dokazali produkciju metalo-β-laktamaza, dok je kod 12/53 (22,6%) ispitivanih sojeva dokazan drugi mehanizam rezistencije E test MBL je bio pozitivan u 41/53(77,36%), MHT kod 39/53 (73,6%), a ROSCO CDT kod 33/53 (62,3%).
Zaključak
- Acinetobacter baumannii uključen u studiju pokazao je visoku rezistenciju na testirane antibiotike i hemioterapeutike. Potpuna rezistencija je zabilježena kod 9/11 (82%) testiranih antibiotika. Rezistencija na Tobramicin iznosila je 30/53 (56,6%), a rezistencija na Colistin nije zabilježena. Dokazali smo da je rezistencija bolničkih izolata Acinetobacter baumannii na karbapeneme najčešće posredovana karbapenemazama čime smo potvrdili radne hipoteze.
- U ukupnom uzorku ispitivani soj Acinetobacter baumannii je najzastupljeniji na Klinici za pedijatriju, Jedinici intenzivne internističke terapije i Klinici za anesteziju i reanimaciju. Dokazana je statistički značajna zastupljenost ispitivanog soja A. baumannii u trahealnom aspiratu i krvi u odnosu na ostale kliničke uzorke
- Od ukupnog broja testiranih sojeva Acinetobacter baumannii kod 41/53 (77,4%) smo dokazali produkciju metalo-β-laktamaza. Naše istraživanje je pokazalo da je E test MBL pouzdan fenotipski test za dokazivanje MBL-a, nakon čega slijede MHT i CDT ROSCO. Kod 12/53 (22,6%) ispitivanih sojeva dokazan je drugi mehanizam rezistencije
- Razvijanjem raznih mehanizama rezistencije, A.baumannii je evoluirao kao jedan od najtežih bolničkih patogena po pitanju kontrole širenja i liječenja infekcija koje uzrokuje. Neophodno je uvođenje novih strategija u terapiji ovog patogena, mjera kontrole infekcija kao i kontinuiranog praćenja njegove pojave u bolničkoj sredini. U svemu navedenom najvažnija uloga mikrobioloških laboratorija je uvođenje brzih i pouzdanih metoda detekcije ovog uzročnika.
- Najpouzdanija metoda detekcije karbapenemaza je amplifikacija gena koji ih kodiraju lančanom reakcijom polimeraze (engl. polymerase chain reaction; PCR). Noviji RT-PCR testovi mogu detektovati gene rezistencije pojedinih karbapenemaza direktno iz kliničkih uzoraka u par sati.
Literatura
- Bergogne-Bérézin, E., Towner, K. J. (1996): Acinetobacter spp. as nosocomial pathogens: microbiological, clinical, and epidemiological features. Clinical Microbiology Reviews, 9:148–165
- Brisou, J., Prevot, A. (1954): Studies on bacterial taxonomy. The revision of species under Achromobacter group. Annales de L’institut Pasteur. Microbiologie (Paris), 86:722-728.
- Baumann, P., Doudoroff, M., Stanier, R. (1968): A study of the Moraxella group II oxidative-negative species (genus Acinetobacter). Journal of Bacteriology, 95:1520-1541.
- Peleg, A.J., Seifert, H., Paterson, D.L. (2008): Acinetobacter baumannii: Emergence of a successful Pathogen; Clinical Microbiology Review, 21(3):538-582.
- Di Nocera, P.P., Rocco, F., Giannouli, M., Triassi, M., Zarrilli, R. (2011): Genome organization of epidemic Acinetobacter baumannii strains. BMC Microbiology, 11(224):1471-218.
- Dijkshoorn, L., Aucken, H.M., Gerner-Smidt, P., Kaufmann, M.E., Ursing, J., Pitt, T.L. (1993): Correlation of typing methods for Acinetobacter isolates from hospital outbreaks. Jurnal of Clinical Microbiology, 31:702–705.
- Kurcik-Trajkovska, B. (2009): Acinetobacter spp. – A serious enemy threatening hospitals Worldwide. Macedonian Journal of Medical Sciences, 2(2):157-162
- Maragakis LL, Perl TM. Acinetobacter baumannii: epidemiology, antimicrobial resistance, and treatment options. Clin Infect Dis 2008;46(8):1254-63.
- Ozgen Koseoglu E, Alper E, Ferda T, Gulsen H. In vitro activity of tigecycline as a therapeutic option against multidrug-resistant Acinetobacter saa. New Microbiol 2008;31:535-42.
- Knežević, P., (2012): Bakteriofagi – alternativni antimikrobni agensi. Zadužbina Andrejević, Beograd, 9-11.
- Roca I, Espinal P, Vila-Farres X, Vila J. The Acinetobacter baumannii oxymoron: commensal hospital dweller turned pan-drugresistant menace. Front Microbio 2012;3:148.
- Lee K, Yong D, Jeong SH, Chong Y. Multidrug-resistant Acinetobacter spp.: increasingly problematic nosocomial pathogens. Yonsei Med J 2011;52: 879–891.
- Ivana Goić-Barišić, Mehanizmi rezistencije na karbapeneme u Acinetobacter baumannii. Infektološki glasnik 29:4, 185–190 (2009) Croatian Journal of Infection 29:4, 185–190 (2009)
- Patel G, Huprikar S, Factor S, Jenkins S, Calfee D. Outcomes of carbapenem-resistant Klebsiella pneumoniae infection and the impact of antimicrobial and adjunctive therapies. Infect Control Hosp Epidemiol 2008;29: 1099–106.
- The European Committee on Antimicrobial Susceptibility Testing [Internet]. Sweden: EUCAST. Breakpoint tables for interpretation of MICs and zone diameters (v 4.0), c2014 [cited 2014 Mar 1]. Available from: http:// www.eucast.org.
- The European Committee on Antimicrobial Susceptibility Testing [Internet]. Sweden: EUCAST. EUCAST guidelines for detection of resistance mechanisms and specific resistances of clinical and/or epidemiological importance (v 1.0) c2013 [cited 2014 Mar 1]. Available from: http://www.eucast.org.
- Health Protection Agency [Internet]. London: HPA. UK Standards for microbiology investigations. Laboratory detection and reporting of bacteria with carbapenemhydrolysing-β-lactamases (carbapenemases). c2013 [cited 2014 Mar 1]. Available from: http://www.hpa.org. uk.
- Centers for Disease Control and Prevention [Internet]. Atlanta: CDC. Department of health and human services. Modified Hodge test for carbapenemase detection in Enterobacteriaceae. c2013 [cited 2014 Mar 1]. Available from: http://www.cdc.gov/hai/pdfs/labsettings/hodgetest_carbapenemase_enterobacteriaceae.pdf.
- Clinical Laboratory Standards Institute [Internet]. Wayne: CLSI. Performance standards for antimicrobial susceptibility testing: twenty-second informational supplement M100–S22. c2012 [cited 2014 Mar 1]. Available from: http://clsi.org/.
- European Centre for Disease Prevention and Control [Internet]. Stockholm: ECDC. Carbapenemase-producing bacteria in Europe: interim results from the European Survey on carbapenemase-producing Enterobacteriaceae. EuSCAPE project. c2013 [cited 2014 Mar 1]. Available from: http://www.ecdc.europa.eu/en/publications/ Publications/antimicrobial-resistance-carbapenemase- producing-bacteria-europe.pdf
- http://hrcak.srce.hr/medicina, 2014, Vol. 50, No. 2, p. 128-149, M. Bubonja-Šonje, M. Abram: Globalno širenje bakterija koje proizvode karbapenemaze
- European Committee on Antimicrobial Susceptibility testing (EUCAST). Guidelines for detection of resistance mechanisms and specific resistances of clinical and/or epidemiological importance. EUCAST, (http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_ files/Consultation/EUCAST_guidelines_detection_of_resistance_mechanisms_ 121222.pdf), dostupno od prosinca 2012.
- Muneeza Anwar,1 Hassan Ejaz,1 Aizza Zafar,1 and Hamdan Hamid2 Phenotypic Detection of Metallo-Beta-Lactamases in Carbapenem Resistant Acinetobacter baumannii Isolated from Pediatric Patients in Pakistan Journal of Pathogens
Volume 2016 (2016), Article ID 8603964, 6 pages
http://dx.doi.org/10.1155/2016/8603964 - Hakyemez IN, Kucukbayrak A, Tas T, Yikilgan AB, Akkaya A, Yasayacak A, et al. Nosocomial Acinetobacter baumannii infections and changing Antibiotic Resistance. Pak J Med Sci 2013;29(5):1245-1248. doi: http://dx.doi.org/10.12669/pjms.295.3885
- M. Noori, A. Karimi, F. Fallah et al., “High prevalence ofmetallo- beta-lactamase producing Acinetobacter baumannii isolated from two hospitals of Tehran, Iran,” Archives of Pediatric Infectious Diseases, vol. 2, no. 3,Article ID e15439, 2014
- G. Mahajan, S. Sheemar, S. Chopra, J. Kaur, D. Chowdhary, and S. K. Makhija, Carbapenem resistance and phenotypic detection of carbapenemases in clinical isolates of Acinetobacter baumannii,” Indian Journal ofMedical Sciences, vol. 65, no. 1, pp. 18–25, 2011
- R.M. L. de Carvalho, S. G. Marques, L. H. B. Gonc¸alves, A. G. Abreu, S. G.Monteiro, and A. G. Gonc¸alves, “Phenotypic detection of metallo-𝛽-lactamases in Pseudomonas aeruginosa and Acinetobacter baumannii isolated from hospitalized patients in S˜ao Luis, State of Maranh˜ao, Brazil,” Revista da Sociedade Brasileira deMedicina Tropical, vol. 46,no. 4, pp. 506–509, 2013
- Weingarten CM1, Rybak MJ, Jahns BE, Stevenson JG, Brown WJ, Levine DP. Evaluation of Acinetobacter baumannii infection and colonization, and antimicrobial treatment patterns in an urban teaching hospital. Pharmacotherapy. 1999 Sep;19(9):1080
- Colonization or Infection with Multidrug-Resistant Acinetobacter baumannii May Be an Independent Risk Factor for Increased Mortality Effrossyni Gkrania-Klotsas1 and Ronald C. Hershow Oxford Journals Medicine & Health Clinical Infectious Diseases Volume 43, Issue 9 Pp. 1224-1225
- Ozdem B, Gurelik FC, Celikbilek N, Balikci H, Acikgoz ZC. Antibiotic resistance profiles of Acinetobacter species isolated from several clinical samples between 2007-2010. Mikrobiyol Bul. 2011;45(3):526-534.
- Protic D, Pejovic A, Andjelkovic D, Djukanovic N, Savic D, Piperac P, Markovic Denic L, Zdravkovic M, Todorovic Z. Nosocomial Infections Caused by Acinetobacter baumannii: Are We Losing the Battle? Surg Infect (Larchmt). 2016 Apr;17(2):236-42. doi: 10.1089/sur.2015.128. Epub 2016 Feb 17.
- Antibiotic Resistance Profiles and Genetic Similarities Within a New Generation of Carbapenem-Resistant Acinetobacter calcoaceticus-A. baumannii Complex Resistotypes in Bosnia and Herzegovina. Çöl A, Dedeić-Ljubović A, Salimović-Bešić I, Hukic M.Microb Drug Resist. 2016 Apr 15. [Epub ahead of print]
- Amer Custovic,Jasmina Smajlovic, Nijaz Tihic, Sadeta Hadzic,Sead Ahmetagic and Haris Hadzagic. Epidemiological Monitoring of Nosocomial Infections Caused byAcinetobacter Baumannii Med Arch. 2014 Dec; 68(6): 402–406. Published online 2014 Dec 16.doi: 10.5455/medarh.2014.68.402-406
- Amudhan SM, Sekar U, Arunagiri K, Sekar B. OXA Beta-lactamase-mediated carbapenem resistance in Acinetobacter baumannii. Indian J Med Microbiol. 2011;29(3):269-74